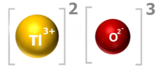Taliuma (III) hidroksido
| Taliuma (III) hidroksido | ||||
| Kemia formulo | ||||
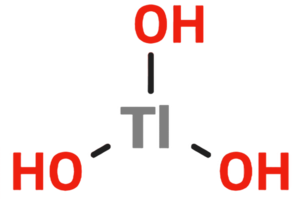 | ||||
Taliuma (III) hidroksido | ||||
 | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| CAS-numero-kodo | 20466441 | |||
| ChemSpider kodo | 15055199 | |||
| PubChem-kodo | 20466441 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blanka, bruna aŭ flaveca toksa solidaĵo[2] | |||
| Molmaso | 255,401g mol−1 | |||
| Solvebleco | Akvo:Nesolvebla Ksp6,3 x 10-46[3] | |||
| Mortiga dozo (LD50) | >517 mg/kg (buŝe) | |||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H300, H330, H373, H411 | |||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P270, P271, P273, P284, P301+316, P304+340, P316, P319, P320, P321, P330, P391, P403+233, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Taliuma (III) hidroksido aŭ trihidroksido de taliumo estas neorganika kombinaĵo apartenanta al la familio de la hidroksidoj, rezultanta el hidratagado de la taliuma (III) oksido aŭ hidrolizo de taliumaj (III) saloj kaj esteroj. Taliuma (III) hidroksido estas blanka, bruna aŭ flaveca, toksa solidaĵo, nesolvebla en akvo kaj uzata en kemiaj sintezoj. Taliuma (III) hidroksido prezentas tri hidroksilajn grupojn ligitan al taliumatomo. Ĝi konsistas je 1 taliumatomo, 3 hidrogenatomoj kaj 3 oksigenatomoj. Ĝenerale derivaĵoj el Tl+3 spertas fotolizan disproporcion al Tl+ kaj Tl+2.
Taliuma (III) hidroksido estas tre malforta bazo; ĝi disiĝas por doni taliuman (III) jonon, Tl+3, nur en forte acidaj kondiĉoj. Brita chemiisto Sir William Crookes malkovris (1861) talion observante la elstaran verdan spektran linion generitan de seleni-enhavantaj piritoj kiuj estis uzitaj en la fabrikado de sulfata acido. Crookes kaj franca apotekisto Claude-Auguste Lamy sendepende izolis (1862) talion, montrante ke ĝi estas metalo.
La kunmetaĵoj de talio en ĝia +3 stato estas facile reduktitaj al kunmetaĵoj de la metalo en ĝia +1 stato. En ĝia oksida stato de +3, talio similas aluminion, kvankam la jono Tl+3 ŝajnas esti tro granda por formi alunojn. Solveblaj taliaj komponaĵoj estas venenaj. La metalo mem estas ŝanĝita al tiaj kunmetaĵoj per kontakto kun humida aero aŭ haŭto. Veneniĝo por talio, kiu povas esti mortiga, kaŭzas nervajn kaj gastrointestinajn malordojn kaj rapidan perdon de hararo. Kaj taliumoza (Tl+) kaj taliumika (Tl+3) estas konsiderataj tre toksaj por homoj kaj hejmaj kaj sovaĝaj organismoj.
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Preparado de taliuma (III) hidroksido per hidrolizo de la taliuma (III) oksido:
Reakcio 2[redakti | redakti fonton]
- Preparado de taliuma (III) hidroksido per traktado de taliuma (III) sulfato kun baria hidroksido
Reakcio 3[redakti | redakti fonton]
- Preparado de taliuma (III) hidroksido per hidrolizo de la taliuma (III) sulfato:
Reakcio 4[redakti | redakti fonton]
- Preparado de taliuma (III) oksido per senhidratigado de taliuma (III) hidroksido:
Reakcio 5[redakti | redakti fonton]
- Reakcio de taliuma (III) hidroksido kun klorida acido donante taliuma (III)n trikloridon:
Reakcio 6[redakti | redakti fonton]
- Preparado de taliuma (III) hidroksido per traktado de taliuma (III) klorido kun kalia karbonato
Reakcio 7[redakti | redakti fonton]
- Reakcio de taliuma (III) hidroksido kun bromo donante taliuma (III)n (III) oksidon:
Reakcio 8[redakti | redakti fonton]
- Preparado de taliuma (III) hidroksido per traktado de taliuma (I) hidroksido kun hidrogena peroksido
Reakcio 9[redakti | redakti fonton]
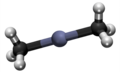
- Preparado de trimetiltaliumo per traktado de taliuma (III) hidroksido kun dumetilzinko:
| Solveblaj saloj de Taliumo (III) | |||
 |
 |
 |  |
| Nesolveblaj saloj de Taliumo (III) | |||
 |
 |
 |  |





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)





![{\displaystyle {\mathsf {{\xrightarrow[{}]{varmo}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39f1c6c7ab29f583de5842596076f1dac2b5b61a)